Cell Res:把肝癌变成“慢病”!厦门大学林圣彩等团队发现“辟谷精”为肝癌治疗开辟代谢免疫新路径实现肝癌小鼠“荷瘤生存”
来源:iNature 2025-12-03 11:10
代谢调节因子AMPK重新平衡肿瘤微环境,使体内的细胞毒性免疫细胞能够消除癌细胞并有效地遏制肿瘤组织。代谢干预可以使癌症成为一种终生可控的疾病,这一发现可能会开启癌症治疗的新时代。
肿瘤组织和肿瘤旁组织的代谢失调都可能导致免疫抑制,这可能是癌症发展的基础。然而,代谢干预作为一种治疗策略一直无效。
2025年11月25日,厦门大学林圣彩团队与福建省肿瘤医院刘景丰团队在Cell Research 在线发表题为Glucose starvation mimetic aldometanib removes immune barriers permitting mice with hepatocellular carcinoma to live to normal ages的研究论文,该研究探索了aldometanib(辟谷精)的抗癌治疗作用,它特异性地靶向溶酶体相关醛缩酶来模拟葡萄糖饥饿,从而激活溶酶体AMP激活的蛋白激酶(AMPK),这是代谢稳态的主要调节剂。
该研究发现aldometanib以AMPK依赖的方式抑制肝细胞癌(HCC)的生长,允许肝癌小鼠存活到成熟年龄,尽管aldometanib对HCC或正常细胞不具有细胞毒性。有趣的是,aldometanib仅在免疫正常的宿主小鼠中发挥抗癌作用,而在免疫缺陷的小鼠中不起作用。该研究还发现,aldometanib治疗小鼠的HCC组织中大量浸润CD8+ T细胞,而在肝脏特异性敲除AMPKα的小鼠中未见这种情况。
因此,该研究结果表明,代谢调节因子AMPK重新平衡肿瘤微环境,使体内的细胞毒性免疫细胞能够消除癌细胞并有效地遏制肿瘤组织。代谢干预可以使癌症成为一种终生可控的疾病,这一发现可能会开启癌症治疗的新时代。

新出现的证据表明,代谢失衡会导致癌症的发生。代谢失调导致细胞内代谢物组成和蛋白质特性的改变,以及肿瘤和肿瘤旁组织之间的细胞外肿瘤微环境(TME)发生改变。肝细胞癌(HCC)是一种被广泛研究与代谢改变相关的癌症。HCC细胞中糖酵解、TCA循环、核苷酸合成、氨基酸代谢、新生脂肪生成和胆固醇合成的代谢改变都与HCC的形成和发展有关。
为了寻找治疗包括肝癌在内的癌症的有效疗法,人们已经做出了巨大的努力,以确定针对各种代谢途径的化合物,其中一些已确定的化合物已经进行了临床试验。出于同样的原因,AMPK作为代谢稳态的主要调节因子,控制着整个代谢网络,也成为筛选临床有用的HCC治疗药物的靶标。
AMPK在葡萄糖生理下降、AMP:ATP或ADP:ATP比率增加所反映的能量水平降低或细胞Ca2+水平的整体变化时被激活。激活后,AMPK磷酸化一系列底物以减缓合成代谢活动,如脂肪酸、胆固醇和蛋白质的合成,这些都是正常细胞和癌细胞增殖的关键组成部分。
他汀类药物通过抑制HMG-CoA还原酶(AMPK的经典底物)来降低胆固醇的合成,或通过直接激活AMPK,已被证明可以减轻HCC的发展。类似地,化合物ND-654通过抑制乙酰辅酶A羧化酶(ACC,用于脂肪酸的从头合成)来抑制HCC的发展,这是AMPK的另一个经典底物。
毫不奇怪,人们一直在努力开发直接靶向AMPK的药物激动剂,以获得治疗HCC的潜在疗效。然而,由于所有亚细胞AMPK池被这些已识别的化学物质不加区分地激活,大多数这些化合物可能具有不利影响。例如,泛AMPK激活剂MK-8722会导致心脏肥厚,尽管它能强有力地激活AMPK并降低血糖。
类似地,虽然线粒体抑制剂通过提高AMP:ATP或ADP:ATP比率激活AMPK,但线粒体本身的抑制可能是有害的,特别是在长期治疗下。然而,令人鼓舞的是,AMPK β1特异性激动剂如PXL770和A769662已显示出缓解肝脏疾病如脂肪肝和非酒精性脂肪性肝炎(NASH)的作用。
之前描述了一种感知葡萄糖下降的途径,在禁食等生理情况下观察到,并传递低糖信号来激活溶酶体表面的AMPK,更重要的是,同时抑制促合成代谢的mTORC1。这种葡萄糖感知-AMPK途径涉及直接感知果糖-1,6-二磷酸(FBP)的可用性,FBP是糖酵解的中间代谢物,是糖酵解醛缩酶的底物。当醛缩酶不被FBP占据时,其作用是抑制内质网定位的TRPV阳离子通道,而TRPV阳离子通道本身在被抑制后,与溶酶体质子泵v-ATP酶发生物理相互作用并抑制。
失活的v-ATPase及其相关蛋白(包括调节复合物)的构象变化导致AXIN-LKB1复合物易位至溶酶体表面;溶酶体定位的AMPK随后被共易位的LKB1磷酸化并被激活。这种激活溶酶体AMPK库的途径还可以实现代谢的时空调节,为识别特异性激活溶酶体AMPK以模拟禁食状态并产生有益效果的化合物提供了靶标。通过这种溶酶体途径激活AMPK的好处可以通过临床剂量的二甲双胍通过这种途径引起各种效果,包括减轻脂肪肝的事实来反映。
以醛缩酶为靶点,研究人员发现了一种名为aldometanib的抑制剂,即使在高糖条件下,它也能特异性地阻止v-ATP酶相关的醛缩酶与FBP结合,而不是参与糖酵解的胞质醛缩酶,从而模拟低糖状态,通过溶酶体途径激活AMPK。肝脏中参与溶酶体途径的因子,如LAMTOR1和AXIN的缺失,会抑制aldometanib介导的AMPK激活。通过AMPK依赖的方式,aldometanib减轻了肥胖啮齿动物的高血糖、脂肪肝和NASH。
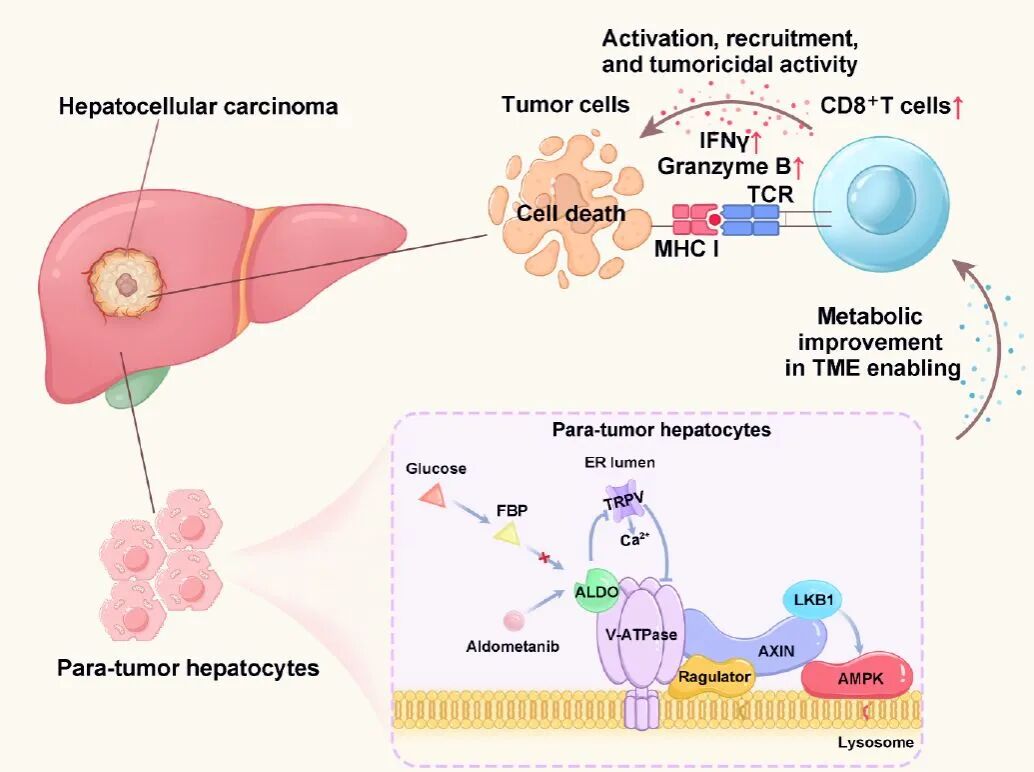
在这项研究中,研究人员探索aldometanib是否可能通过纠正代谢失调来治疗HCC,代谢失调可能因病理情况(如肝炎或脂肪肝)而加重,脂肪肝是肝癌发展的最普遍的先决条件。虽然aldometanib不会对细胞产生细胞毒性,但研究人员发现aldometanib可以显著抑制二乙基亚硝胺(DEN)处理和高脂肪饮食(HFD)喂养的小鼠(DEN-HFD小鼠)、肝脏敲除Trp53并过表达Myc的小鼠(Myc;Trp53−/−HCC)以及由HCC细胞系建立的原位同种异体移植物的肝癌生长和发展。
值得注意的是,aldometanib治疗使携带HCC的DEN-HFD小鼠能够活到成熟年龄。研究人员还发现aldometanib治疗诱导CD8+细胞毒性T细胞大量包围和浸润肿瘤组织,而不是肝脏。这些观察结果表明,aldometanib激活AMPK,使肿瘤环境恢复到允许免疫细胞迁移的状态,从而作为免疫系统防御癌症发展的杠杆,使患癌小鼠能够存活到成熟。
厦门大学生命科学学院博士生胡辉辉为论文第一作者,福建省肿瘤医院研究员王雪枫,兰斌为论文共同第一作者,厦门大学林圣彩院士,张宸崧教授,福建省肿瘤医院刘景丰教授为通讯作者。该研究得到了国家科技部重点研发计划,国家自然科学基金等资助。
https://www.nature.com/articles/s41422-025-01195-4
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


